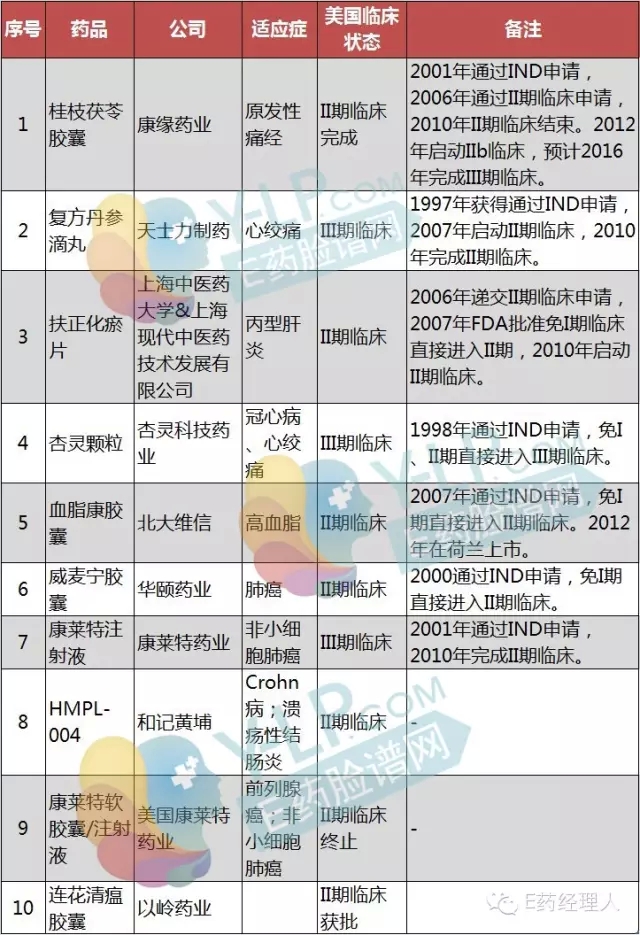
天士力透露,其復(fù)方丹參滴丸在美國(guó)FDA的三期臨床試驗(yàn)已經(jīng)完成。有望成為第一個(gè)成功闖關(guān)美國(guó)FDA的復(fù)方中成藥。據(jù)悉,目前復(fù)方丹參滴丸已經(jīng)在全球9個(gè)國(guó)家的126個(gè)臨床中心,做完三期臨床試驗(yàn)。這也意味著藥品上市前的最后一次臨床做完了。現(xiàn)正按照美國(guó)FDA的程序關(guān)閉實(shí)驗(yàn)室,清理實(shí)驗(yàn)現(xiàn)場(chǎng),統(tǒng)計(jì)數(shù)據(jù)。
有多個(gè)中國(guó)制藥企業(yè)主導(dǎo)的中成藥IND研究已經(jīng)進(jìn)入后半程,并且有望獲得重大突破。例如繼天士力的復(fù)方丹參滴丸開(kāi)展fda注冊(cè)后,上海現(xiàn)代中醫(yī)藥股份公司研發(fā)的“扶正化瘀片ⅱ期臨床試驗(yàn)”也上馬了。北大維信生物科技有限公司生產(chǎn)的血脂康2007年通過(guò)IND申請(qǐng),免I期直接進(jìn)入II期臨床。2013年已經(jīng)完成II期臨床試驗(yàn),III期臨床試驗(yàn)也在積極籌備中。